En el año 2023 el Centro para la Evaluación e Investigación de Medicamentos (CDER) de la Food and Drug Administration de Estados Unidos (FDA) aprobó 55 nuevos fármacos, 18 más de los que ese organismo aprobó en el año 2022, que fueron 37. Es el cuarto año con 50 o más moléculas aprobadas de la última década.
El siguiente gráfico de 10 años (Nº1), muestra que desde 2014 hasta 2023, FDA ha aprobado 456 drogas.
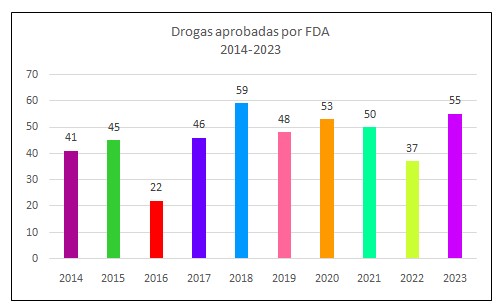 Gráfico Nº1. Fuente FDA. Producción propia
Gráfico Nº1. Fuente FDA. Producción propia
Cada año, CDER aprueba una amplia gama de nuevos fármacos y productos biológicos.
Algunos de estos son productos innovadores que nunca se han utilizado en la práctica clínica. Otros son los mismos, o están relacionados con productos previamente aprobados, pero con otras indicaciones.
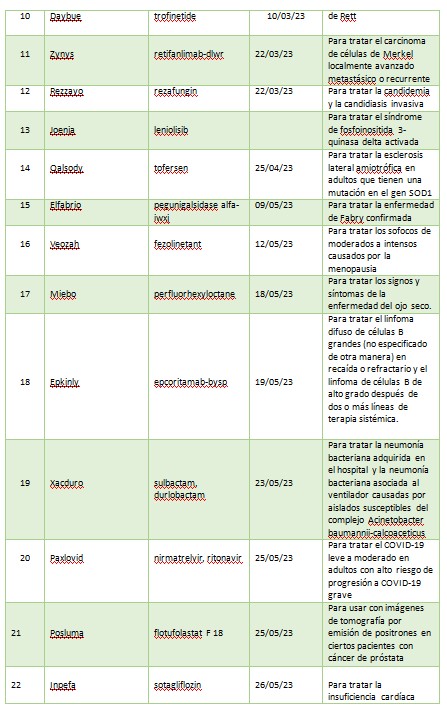
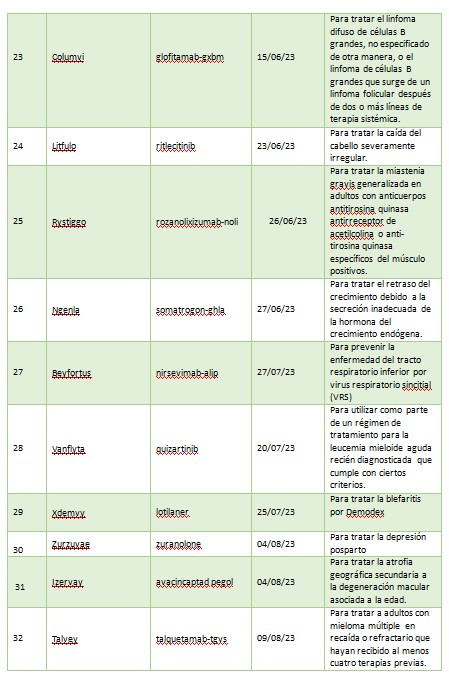
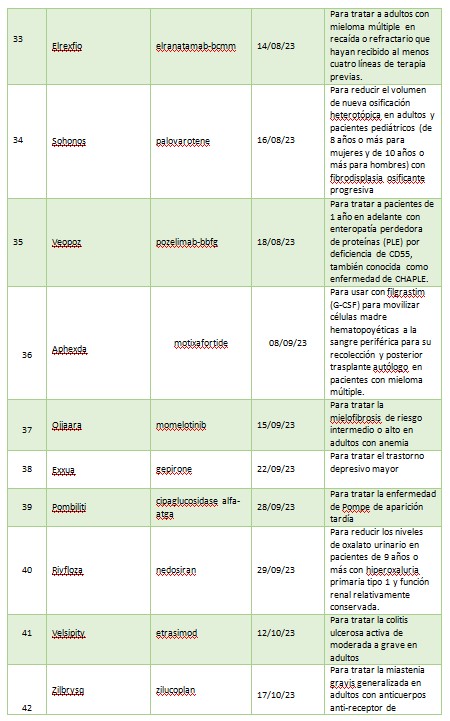
A continuación, se muestra una lista de nuevas entidades moleculares y productos biológicos terapéuticos aprobados por el CDER en 2023. Esta lista no contiene vacunas, productos alergénicos, sangre y productos sanguíneos, derivados del plasma, productos de terapia celular y genética u otros productos aprobados en 2023 por el Centro de Evaluación e Investigación Biológica.
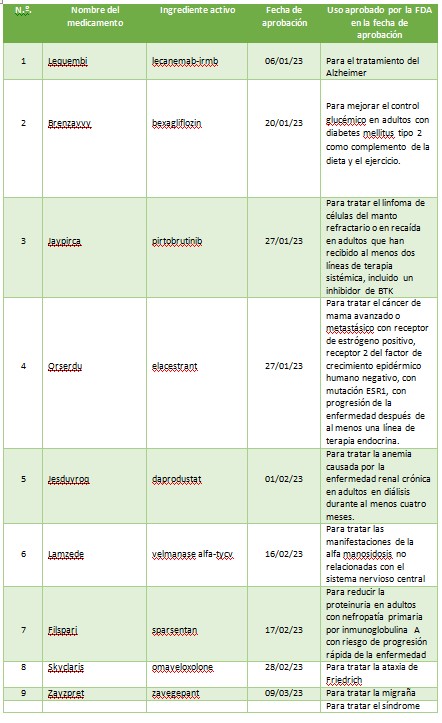

La primera aprobación del año fue para Lequembi (Lecanemab -irmb) para el mal de Alzheimer. Si bien no es una cura, es un tratamiento que aborda la biología subyacente del Alzheimer y cambia el curso de la enfermedad de manera significativa para las personas que se encuentran en las etapas tempranas.
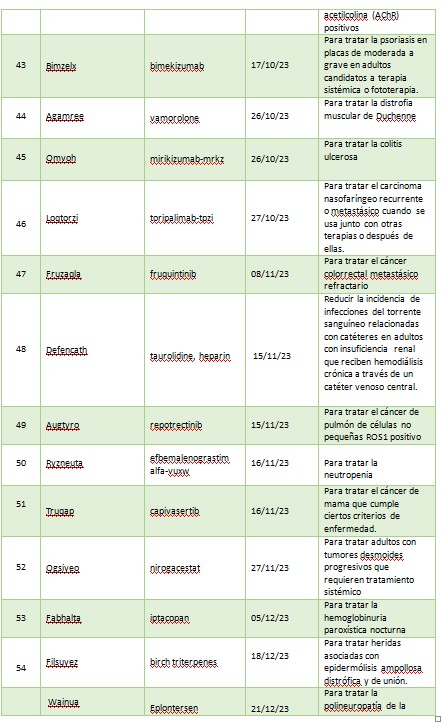
2023 fue otro año sólido para poner a disposición de pacientes nuevas terapias contra el cáncer. De las 55 aprobaciones, 12 fueron drogas oncológicas. Se aprobaron nuevas drogas para ciertos pacientes con cáncer de mama, pulmón, mielomas, linfomas, leucemia, cáncer nasofaríngeo, cáncer colorrectal entre otros. Los productos autorizados son: Jaypirca, Orserdu, Zynyz, Epkinly, Columvi, Vanflyta, Talvey, Elrexfio, Loqtorzi, Fruzaqla, Augtyro, Truqap.
La FDA dio luz verde a Ogsiveo, a base de nirogacestat, para tratar tumores desmoides, que se caracterizan por crecimientos no cancerosos de tejidos blandos que a menudo causan dolor intenso y desfiguración.
Aprobó también Ryzneuta, un factor de crecimiento de leucocitos, para disminuir la incidencia de infección, que se manifiesta en neutropenia febril, en pacientes adultos con neoplasias malignas no mieloides que recibieron fármacos anticancerígenos.
En cuanto a antimicrobianos aprobó Xacduro (sulbactam inyectable; durlobactam inyectable), un nuevo tratamiento para la neumonía bacteriana adquirida en el hospital y la neumonía bacteriana asociada al ventilador, causada por cepas susceptibles de bacterias llamadas complejo Acinetobacter baumannii-calcoaceticus, para pacientes de 18 años y mayores.
En el área de productos oftalmológicos se aprobó Izervay, para la atrofia geográfica secundaria a la degeneración macular causada por la edad. El principio activo es avacincaptad pegol, una solución de aplicación intravítrea. También le dio el visto bueno a Miebo, único medicamento para el ojo seco que está diseñado específicamente para reducir la evaporación de la lágrima al disminuir la disfunción de las glándulas de Meibomio. En la misma categoría aprobó Xdemvy para el tratamiento de la blefaritis, el cual es un ectoparasiticida que se dirige a los ácaros del Demodex que invaden y residen en los folículos pilosos de las pestañas.
La colitis ulcerosa también tuvo su lugar en las aprobaciones de la agencia norteamericana. En primer lugar, le dio el visto bueno a Velsipity para el tratamiento de la colitis ulcerosa de moderada a grave en adultos para quienes el tratamiento convencional o con agente biológico no sea posible. Luego aprobó Omvoh, que contiene el principio activo mirikizumab, un anticuerpo monoclonal no recomendado para menores de 18 años.
FDA avaló Qalsody, Inyección intratecal para el tratamiento de pacientes adultos con esclerosis lateral amiotrófica (ELA) con la mutación genética SOD1 (superóxido dismutasa 1).
Durante 2023 la psoriasis estuvo presente con la aprobación de un nuevo producto: Bimzelx, cuyo principio activo es bimekizumab. Está indicada para la psoriasis en placas de moderada a grave en adultos candidatos a terapia sistémica o fototerapia.
FDA aprobó Zurzuvae (zuranolona), el primer medicamento oral indicado para tratar la depresión posparto (DPP) en mujeres adultas. En el mismo sentido aprobó el clorhidrato de gepirona de liberación prolongada, mejor conocido como Exxua, para el tratamiento del trastorno depresivo mayor en adultos.
Productos para entidades morbíficas tales como la migraña, diabetes, la caída del cabello, la candidiasis invasiva, la anemia de pacientes en diálisis, miastenia gravis, los sofocos de la menopausia, entre otras patologías, también han recibido la aprobación de la FDA durante 2023.
La última droga aprobada fue Wainua, para pacientes con polineuropatía o daño nervioso causado por amiloidosis hereditaria por transtiretina (ATTR-PN), que afecta a unos 40.000 pacientes en todo el mundo.
Fuente FDA
